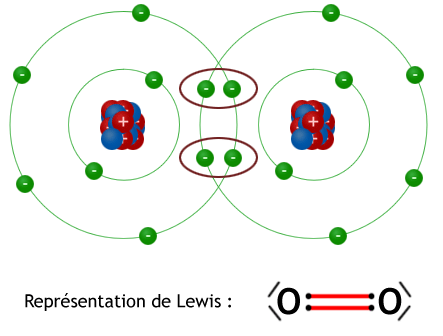
 La formation des molécules est le résultat d’un assemblage des atomes. Une molécule nait lorsque les atomes mettent en commun ou cèdent des électrons entre eux. C’est pour cette cause que la molécule est plus stable que chaque atome isolé. Dans certains cas, des électrons seront cédés d'un atome à un autre afin que chacun des deux atomes atteigne un état stable. Dans d’autres cas, la liaison entre les atomes se justifie par le fait que ce deux atomes sont chargés des signes contraire (+/-). Liaison covalente normale parfaite Dans une liaison covalente normale parfaite, les électrons sont attirés par les deux noyaux. Toute fois, ces noyaux se repoussent entre eux jusqu'à une distance où la force d’attraction est égale à la force de répulsion. C’est grâce à la présence des électrons, il est possible de combiner les charges afin de former une molécule électriquement neutre également. Pour les molécules homo-atomique, chaque élément va avoir tendance à essayer d'obtenir la configuration électronique du Gaz rare le plus proche. Exemple : La molécule d' H2 (dihydrogène) : chaque atome est constitué d'un proton (+) autour duquel gravite un électron (-). Il y a une force d'attraction qui s'exerce entre le proton et l'électron appartenant au même atome. Ces mêmes éléments étant attirés également par ceux de l'atome voisin. Chaque atome d'hydrogène est électriquement neutre. Pourtant, ils sont composés de charges positives et négatives. Ainsi, en moyenne, les électrons dans la molécule de dihydrogène ( H2 ) se trouvent entre les deux noyaux d'hydrogène. Représentons la même chose mais avec le modèle de Lewis : Les deux électrons sont mis en communs et perdent leur appartenance à l'un ou à l'autre atome. Ils sont mis en communauté. Ces deux électrons forment une paire électronique. Dès lors, chaque atome de H est entouré de deux électrons et a atteint la configuration plus stable de L'Hélium. Cette mise en commun est appelée liaison covalente ou covalence. Liaison covalente normale polarisée
Comme nous l’avons vue dans les propriétés de l’atome, L'électronégativité d'un élément désigne la force d'attraction que cet élément exerce sur les électrons d'une liaison. Le chimiste et physicien américain Linus Pauling a déterminé de façon arbitraire l'échelle d'électronégativité. L'élément le plus électronégatif est le Fluor (4) et le moins électronégatif est le Césium (0,7). L'électronégativité des autres éléments varie entre ces deux mesures. L'électronégativité augmente de gauche à droite dans une période et de bas en haut dans une même famille. L'électronégativité par le symbole c. Une liaison covalente normale polarisée a lieu lorsque la différence d’électronégativité Δc est inférieure ou égale à 1,5. On obtient la différence d’électronégativité en faisant la soustraction entre la plus grande valeur et la plus base valeur. Exemple : HCl qui est H qui donne son electron à Cl tout en neutralisant la molécule avec l’énergie positive de son proton. Il est important de savoir que l'electron de H est plus souvent au cotée de Cl sans avoir été arracher. La Liaison ionique Une liaison ionique résulte d'une attraction entre ions formés par transfert d'électrons entre atomes d'électronégativités très différentes (Δc> 2) de l'atome le moins électronégatif vers l'atome le plus électronégatif. Lorsque la différence d'électronégativité est supérieure à 2, les forces en présence s'exerçant sur les électrons de l'élément le moins électronégatif sont suffisantes pour lui arracher définitivement un ou plusieurs électrons. Il ne s'agit donc plus d'une mise en commun, mais d'un don. Les charges seront donc complètes, l'élément le moins électronégatif perd un ou plusieurs électrons et devient donc un ion positif (cation) et l'élément le plus électronégatif reçoit un ou plusieurs électrons et devient donc un ion négatif (anion). Les interactions entres ces éléments sont alors des interactions d'ordre électrostatique (Force de Coulomb).
2 Commentaires
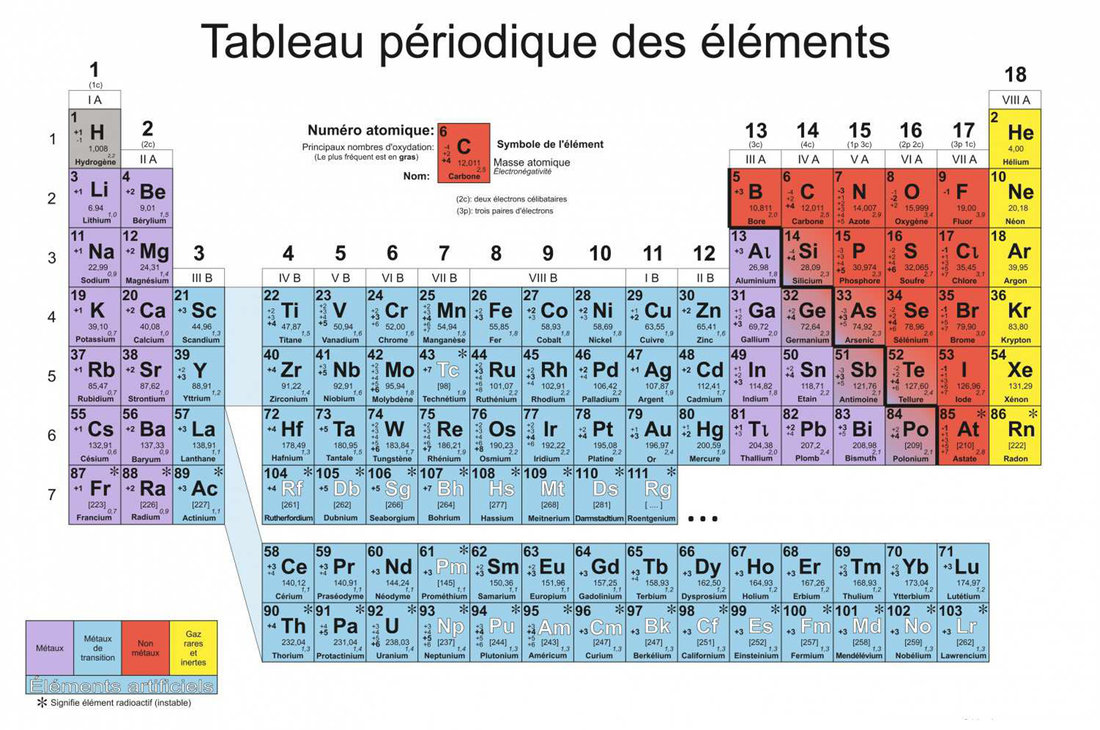
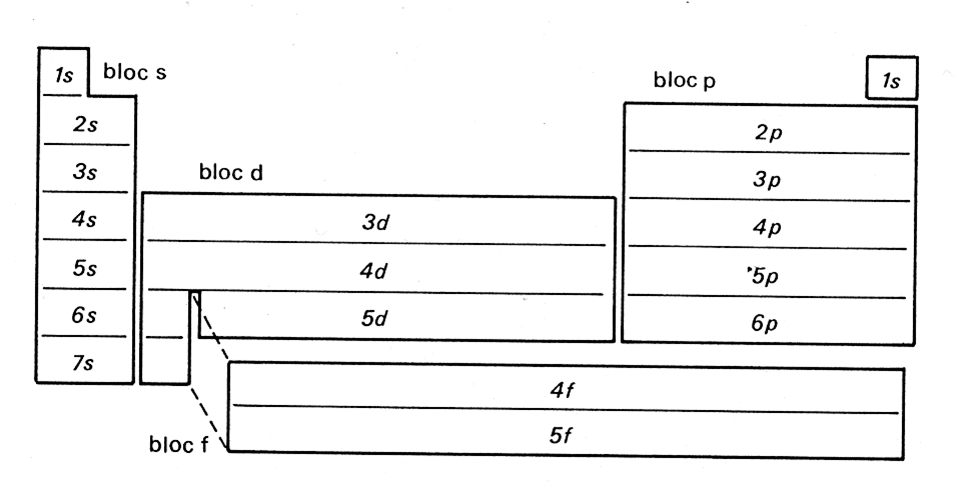
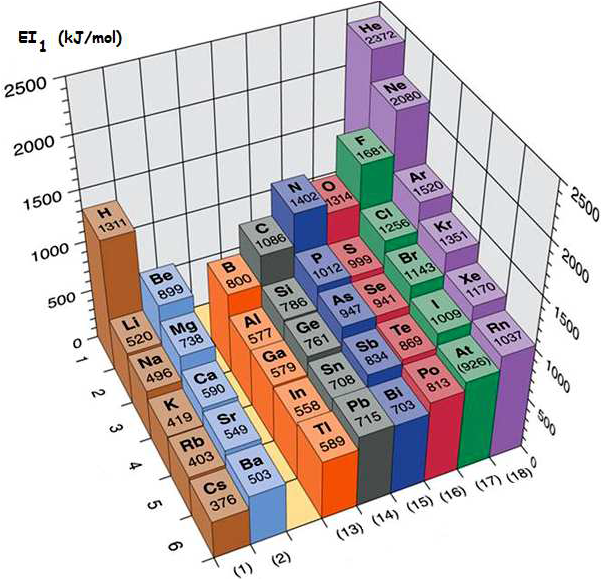
Pour comprendre le tableau périodique, il est important de comprendre la structure d’un atome. Structure électronique de l’Atome. Dans un atome, la répartition des électrons sur les orbitales atomiques d’un atome obéit à des règles. Principe de stabilité Les électrons occupent les orbitales atomiques par ordre croissant d’énergie. Le classement énergétique des orbitales atomiques se fait plus simplement selon la règle de Klechkowski. Ordre énergétique des orbitales atomiques : 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < ….. on constate que l’énergie croît avec n+l Principe de Pauli Les électrons d’un même atome ne peuvent pas avoir les mêmes quatre nombres quantiques. En conséquence, chaque orbitale atomique, caractérisée par n, l et ml contient au maximum deux électrons à spins opposés ( ½ et – ½) . Remarque : Une orbitale peut être représentée par une case ( ) dite case quantique. Chaque case quantique peut contenir au maximum, deux électrons antiparallèles (à spins opposés) Pour chaque valeur de n, il existe n2 cases quantiques ou orbitales atomiques, et par conséquent 2n2 électrons. Principe de Hund A l’état fondamental, les électrons d’une même sous couche se répartissent sur le maximum d’orbitales atomiques (orbitales atomiques dégénérées). Exception à la règle de Klechkowski L’énergie de la sous-couche (n+1)s devient supérieure à celle de nd une fois cette dernière contient un ou plusieurs électrons. Exemples: Fe, Sc, Ni… Classification des éléments chimiques Le classement des éléments se fait selon Z croissant et prend en considération la structure électronique des atomes. Les éléments dont les atomes ont la même couche externe (même n) sont rangés dans une période (ligne). Les éléments de même structure électronique externe possèdent des propriétés chimiques similaires et de ce fait, ils sont rangés dans la même colonne. Le tableau périodique comporte environ 103 éléments y compris les éléments artificiels, et se compose de 4 blocs (s, p, d et f). Bloc s (Métaux actifs) : ns1 ® alcalin et ns2 ® alcalino-terreux Bloc p (ns2npz ; 1 ≤ z ≤ 6) : Exemples: Chalcogènes (ns2np4); Halogènes (ns2np5); Gaz rares (ns2np6). Les éléments de ce bloc tels que: Si, Ge, As, Sb et Po sont des métalloïdes. Bloc d (Métaux de transition) : (n-1) dy ns2 (1 ≤ y ≤ 10) Bloc f : (n-2)fz (n-1)d ns2 ; 1 ≤ z ≤ 14. Exemples: Lanthanides (4fz 5d 6s2); Actinides (5fz 6d 7s2). Les propriétés de l’atome dépendent particulièrement de sa taille et de sa configuration électronique externe, à savoir des électrons de la couche externe. Parmi les propriétés qui peuvent donner une idée sur le comportement chimique de l’atome on cite : - l’aptitude à perdre ou à gagner des électrons, - la capacité de déformation du nuage électronique. Énergie d’ionisation Elle correspond à l’énergie minimale nécessaire pour arracher un électron d’un atome, pris à l’état gazeux. L’énergie reçue notée EI1 (énergie de première ionisation) est toujours positive. La perte d’un second électron conformément à la transformation : e nécessite une énergie EI2, appelée énergie de la deuxième ionisation. A l’exception de certains éléments, EI1 augmente avec Z le long d’une période, et diminue lorsque Z augmente dans une même colonne. La valeur de EI1 peut être déterminée par le calcul des énergies électroniques des espèces considérées. Affinité électronique La fixation d’un électron par un atome A(g), pris à l’état isolé, pour donner lieu à l’anion A-(g), selon la transformation: S’accompagne d’un échange de chaleur DH. Par convention, l’affinité électronique (AE) de l’atome est égale à - DH (AE = - DH). AE peut être positive ou négative. Elle est généralement déterminée par le calcul (par exemple par l’usage du cycle de Born-Haber). Ci-après des valeurs de AE de certains éléments. AE n’évolue pas de manière uniforme en fonction de Z.
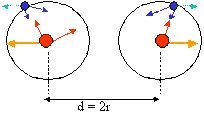
Rayon atomique En se référant aux résultats de la mécanique quantique, l’atome n’a pas de frontière et la notion de rayon atomique est superflue. Toutefois, pour comparer la taille des atomes et avoir une idée sur la longueur des liaisons, on définit le rayon atomique comme la demi-distance entre les deux noyaux d’une molécule homonucléaire. Il s’agit alors du rayon covalent. Dans une période, le rayon atomique diminue quand Z augmente ; et dans une colonne il augmente lorsque Z augmente. Définition : Une solution est un mélange homogène qui est constitue par le solvant et le soluté . Solution = soluté +solvant Le constituant dont les molécules sont en plus grand nombre (en plus grande quantité) est généralement appelé solvant (ou dissolvant); tandis que le constituant dont les molécules sont en plus petit nombre est appelé soluté ou corps dissous . Il existe des solutions solide, liquide et gazeux. En Chimie analytique on utilisera des solutions aqueuses c’est- à -dire celle qui ont comme solvant l’eau. Il existe d’autres solvants employés pour faire des solutions liquides, citons : tétrachlorure de carbone, acide acétique, acétone, benzène, éther. Pour définir quantitativement une solution on doit indiquer la concentration c’est- à -dire la quantité respective du corps dissous et du solvant entrant dans la composition de l’ensemble ou encore les rapports entre la quantité du soluté et celle du solvant ou celle de la solution. A) expressions de la concentration Il existe deux types d’expression de la concentration :
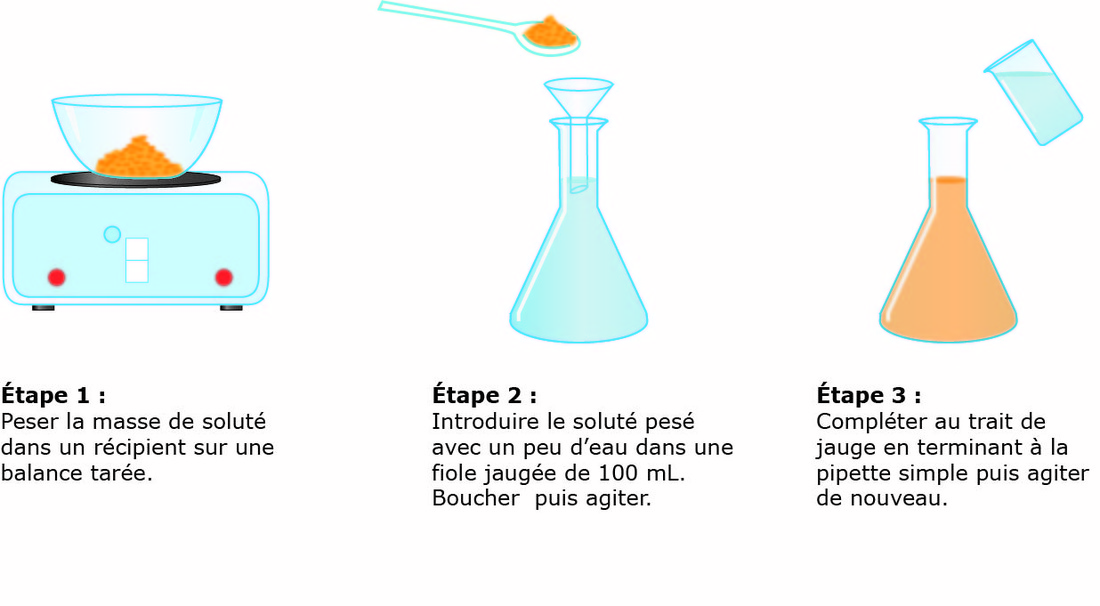
a) titre pondéral ou concentration massique ou encore concentration en gramme par litre C’est la masse en gramme par litre (g/l) contenue dans un litre de solution ,il est symbolise par C ou T ou [ ] est sa formule est : Il ne faut jamais confondre la concentration en g/l avec la masse volumique P :
-T =2g/l de H2SO4, c’est -à-dire que dans un litre de solution on a deux gramme de H2SO4 NB : le titre pondéral exprimer en g/l s’appelle titre d’une solution b. le pourcentage massique ou pourcentage ou masse ou degré de pureté Le pourcentage en masse d’une solution est la masse du soluté contenue dans 100 gramme de la solution . Ou m =masse du soluté mt= masse de la solution ou masse totale. Le rapport m/mt est appelé fraction massique ou teneur (W) 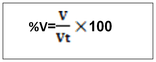 le pourcentage volumique : % V Le pourcentage en volume d’une solution est le volume du soluté contenu dans 100 ml d’une solution. Ou V = volume du soluté Vt = volume de la solution. Note : le pourcentage en masse est le plus utilisé. Quand on ne présente que le signe de pourcentage, il s’agit donc du % en masse. Ex : Na Cl 98%, ici il s’agit donc du pourcentage en masse. a)le pourcentage poids sur volume  http://rovaltainresearch.com/ http://rovaltainresearch.com/ La chimie analytique étudie les méthodes utilisées pour déceler et doser les substances libres ou mélanges combiné. Elle recherche à identifier (chimie analytique qualitative) et à doser (chimie analytique quantitative) les substances chimiques. Outre les instrumentales d’analyse. Il existe quatre grand procédé d’analyse quantitative ou de dosage c’est sont :
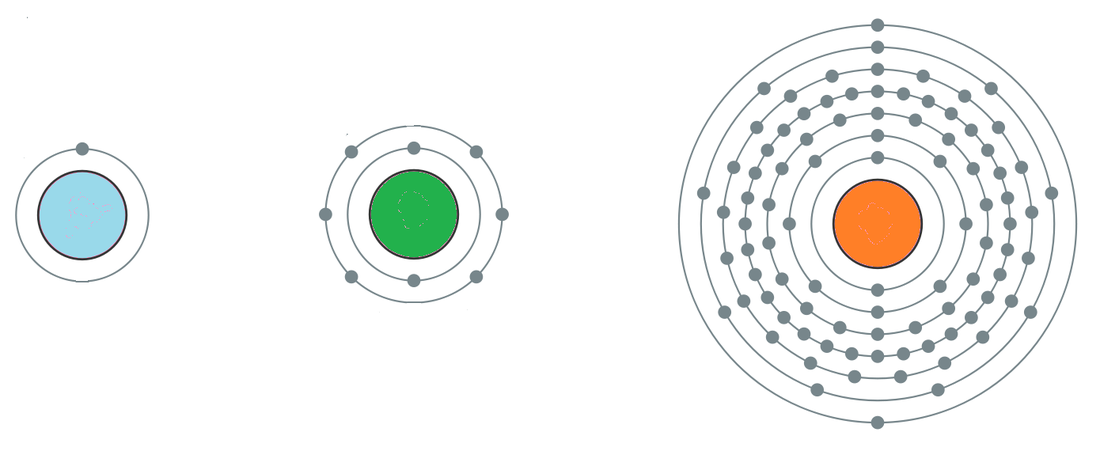
La matière est constituée de particules élémentaires appelées atomes (le mot dérive de ″ atomos ″ qui signifie l’indivisible en Grecque). La masse et le rayon d’une telle particule sont respectivement de l’ordre de 10(-26) kg et 10(-10)m.
L’atome, à son tour, est composé de particules dont les principales sont : protons, neutrons et électrons. Les protons et les neutrons, appelés nucléons, sont constitués chacun de 3 quarks, et forment le noyau de l’atome. La charge et la masse des principales particules subatomiques sont données dans le tableau suivant. Particules Électron (e− ) Proton (p) Neutron (n) Masse (m) en kg 9,109 10(−31) 1,672 10(−27) 1,675 10(−27) Charge (q) en coulombs (C) − 1,602 10(−19) + 1,602 10(−19) 0 Remarques : • mp ≈ mn ≈ 1836 me • |q e-| = |qp| • La masse de l’atome est pratiquement égale à celle du noyau. • Le diamètre du noyau est de l’ordre de 10(−14)m, et sa masse volumique avoisine 1012g/cm(3). Cette valeur est gigantesque par comparaison à celles des masses volumiques usuelles. Représentation symbolique de l’atome Par convention, l’atome d’un élément X est représenté par le symbole AZX, où Z est le numéro atomique qui est égal au nombre de protons. Z est aussi égale au nombre d’électrons dans le cas d’un atome neutre. A est le nombre de masse ; il est égal au nombre des nucléons (protons + neutrons). Exemples: (1)(1)H (hydrogène); Unité de masse atomique (uma) L’unité de la masse (kg) adoptée dans le cas des objets macroscopiques ne convient pas dans le cas des particules subatomiques, dont la masse est de l’ordre de 10 (−27) kg. Pour définir une nouvelle unité plus adaptée, il a été convenu de considérer que l’isotope (6)(12)C soit la référence pour tous les éléments et que sa masse est égale à 12 uma. Il en découle : 1 uma = 1,66 10(-24) g N est le nombre d’Avogadro (6,022 1023 mol(−1)) Dans ce cas les masses des nucléons et de l’électron exprimées en uma sont : mp = 1,0071 ; mn = 1,0089 ; me = 5,486 10(−4) Il peut être remarqué que le nombre de masse (A) représente la masse de l’atome en uma. La masse molaire d’un élément, exprimée en gramme, correspond à la masse de N atomes de cet élément, soit une mole. NB: Les chiffres entre parenthèse sont des exposants des chiffres qui le précèdent. Notre équipe est entrain de travailler sur la résolution de cette situation. |
Archives
Avril 2016
Catégories |



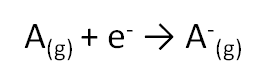

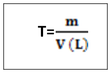
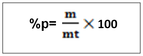
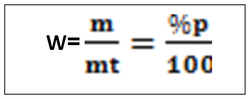
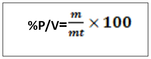

 Flux RSS
Flux RSS
