|
Définition : Une solution est un mélange homogène qui est constitue par le solvant et le soluté . Solution = soluté +solvant Le constituant dont les molécules sont en plus grand nombre (en plus grande quantité) est généralement appelé solvant (ou dissolvant); tandis que le constituant dont les molécules sont en plus petit nombre est appelé soluté ou corps dissous . Il existe des solutions solide, liquide et gazeux. En Chimie analytique on utilisera des solutions aqueuses c’est- à -dire celle qui ont comme solvant l’eau. Il existe d’autres solvants employés pour faire des solutions liquides, citons : tétrachlorure de carbone, acide acétique, acétone, benzène, éther. Pour définir quantitativement une solution on doit indiquer la concentration c’est- à -dire la quantité respective du corps dissous et du solvant entrant dans la composition de l’ensemble ou encore les rapports entre la quantité du soluté et celle du solvant ou celle de la solution. A) expressions de la concentration Il existe deux types d’expression de la concentration :
a) titre pondéral ou concentration massique ou encore concentration en gramme par litre C’est la masse en gramme par litre (g/l) contenue dans un litre de solution ,il est symbolise par C ou T ou [ ] est sa formule est : Il ne faut jamais confondre la concentration en g/l avec la masse volumique P :
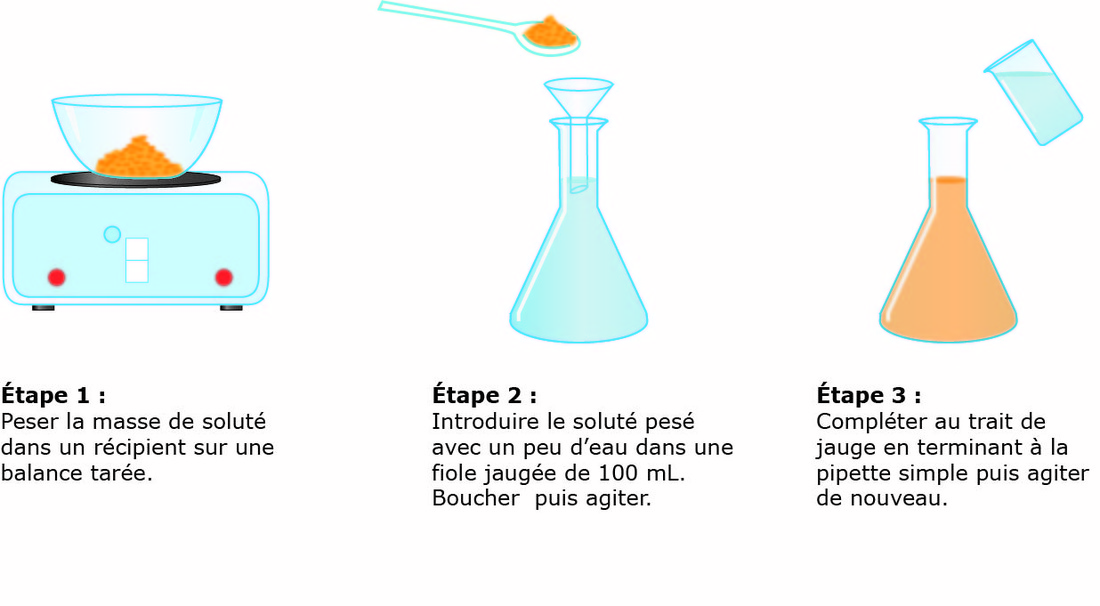
-T =2g/l de H2SO4, c’est -à-dire que dans un litre de solution on a deux gramme de H2SO4 NB : le titre pondéral exprimer en g/l s’appelle titre d’une solution b. le pourcentage massique ou pourcentage ou masse ou degré de pureté Le pourcentage en masse d’une solution est la masse du soluté contenue dans 100 gramme de la solution . Ou m =masse du soluté mt= masse de la solution ou masse totale. Le rapport m/mt est appelé fraction massique ou teneur (W) 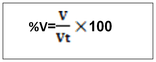 le pourcentage volumique : % V Le pourcentage en volume d’une solution est le volume du soluté contenu dans 100 ml d’une solution. Ou V = volume du soluté Vt = volume de la solution. Note : le pourcentage en masse est le plus utilisé. Quand on ne présente que le signe de pourcentage, il s’agit donc du % en masse. Ex : Na Cl 98%, ici il s’agit donc du pourcentage en masse. a)le pourcentage poids sur volume
3 Commentaires
 http://rovaltainresearch.com/ http://rovaltainresearch.com/ La chimie analytique étudie les méthodes utilisées pour déceler et doser les substances libres ou mélanges combiné. Elle recherche à identifier (chimie analytique qualitative) et à doser (chimie analytique quantitative) les substances chimiques. Outre les instrumentales d’analyse. Il existe quatre grand procédé d’analyse quantitative ou de dosage c’est sont :
|
Archives
Avril 2016
Catégories |

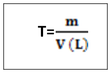
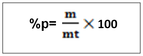
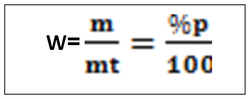
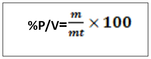
 Flux RSS
Flux RSS
