|
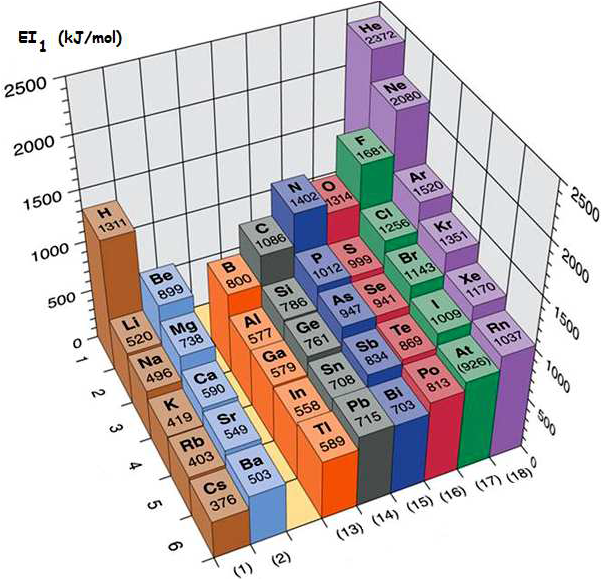
Les propriétés de l’atome dépendent particulièrement de sa taille et de sa configuration électronique externe, à savoir des électrons de la couche externe. Parmi les propriétés qui peuvent donner une idée sur le comportement chimique de l’atome on cite : - l’aptitude à perdre ou à gagner des électrons, - la capacité de déformation du nuage électronique. Énergie d’ionisation Elle correspond à l’énergie minimale nécessaire pour arracher un électron d’un atome, pris à l’état gazeux. L’énergie reçue notée EI1 (énergie de première ionisation) est toujours positive. La perte d’un second électron conformément à la transformation : e nécessite une énergie EI2, appelée énergie de la deuxième ionisation. A l’exception de certains éléments, EI1 augmente avec Z le long d’une période, et diminue lorsque Z augmente dans une même colonne. La valeur de EI1 peut être déterminée par le calcul des énergies électroniques des espèces considérées. Affinité électronique La fixation d’un électron par un atome A(g), pris à l’état isolé, pour donner lieu à l’anion A-(g), selon la transformation: S’accompagne d’un échange de chaleur DH. Par convention, l’affinité électronique (AE) de l’atome est égale à - DH (AE = - DH). AE peut être positive ou négative. Elle est généralement déterminée par le calcul (par exemple par l’usage du cycle de Born-Haber). Ci-après des valeurs de AE de certains éléments. AE n’évolue pas de manière uniforme en fonction de Z.
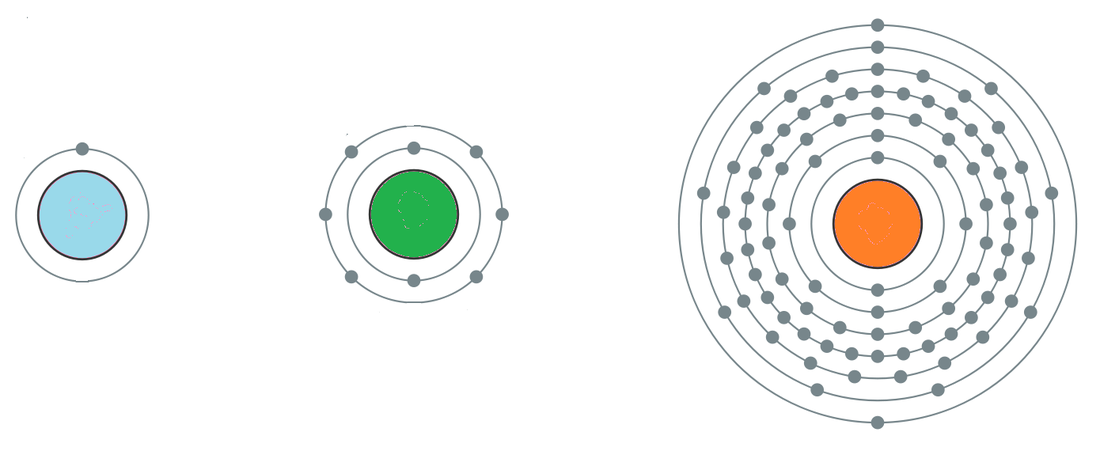
Rayon atomique En se référant aux résultats de la mécanique quantique, l’atome n’a pas de frontière et la notion de rayon atomique est superflue. Toutefois, pour comparer la taille des atomes et avoir une idée sur la longueur des liaisons, on définit le rayon atomique comme la demi-distance entre les deux noyaux d’une molécule homonucléaire. Il s’agit alors du rayon covalent. Dans une période, le rayon atomique diminue quand Z augmente ; et dans une colonne il augmente lorsque Z augmente.
2 Commentaires
Bahoza Gustave Aga
19/4/2016 09:27:28 am
ok
Répondre
Laisser un réponse. |
Archives
Avril 2016
Catégories |


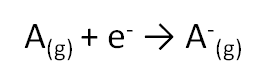

 Flux RSS
Flux RSS
