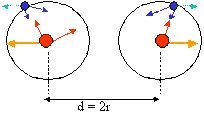
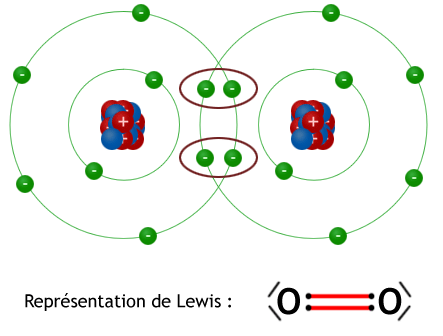
 La formation des molécules est le résultat d’un assemblage des atomes. Une molécule nait lorsque les atomes mettent en commun ou cèdent des électrons entre eux. C’est pour cette cause que la molécule est plus stable que chaque atome isolé. Dans certains cas, des électrons seront cédés d'un atome à un autre afin que chacun des deux atomes atteigne un état stable. Dans d’autres cas, la liaison entre les atomes se justifie par le fait que ce deux atomes sont chargés des signes contraire (+/-). Liaison covalente normale parfaite Dans une liaison covalente normale parfaite, les électrons sont attirés par les deux noyaux. Toute fois, ces noyaux se repoussent entre eux jusqu'à une distance où la force d’attraction est égale à la force de répulsion. C’est grâce à la présence des électrons, il est possible de combiner les charges afin de former une molécule électriquement neutre également. Pour les molécules homo-atomique, chaque élément va avoir tendance à essayer d'obtenir la configuration électronique du Gaz rare le plus proche. Exemple : La molécule d' H2 (dihydrogène) : chaque atome est constitué d'un proton (+) autour duquel gravite un électron (-). Il y a une force d'attraction qui s'exerce entre le proton et l'électron appartenant au même atome. Ces mêmes éléments étant attirés également par ceux de l'atome voisin. Chaque atome d'hydrogène est électriquement neutre. Pourtant, ils sont composés de charges positives et négatives. Ainsi, en moyenne, les électrons dans la molécule de dihydrogène ( H2 ) se trouvent entre les deux noyaux d'hydrogène. Représentons la même chose mais avec le modèle de Lewis : Les deux électrons sont mis en communs et perdent leur appartenance à l'un ou à l'autre atome. Ils sont mis en communauté. Ces deux électrons forment une paire électronique. Dès lors, chaque atome de H est entouré de deux électrons et a atteint la configuration plus stable de L'Hélium. Cette mise en commun est appelée liaison covalente ou covalence. Liaison covalente normale polarisée
Comme nous l’avons vue dans les propriétés de l’atome, L'électronégativité d'un élément désigne la force d'attraction que cet élément exerce sur les électrons d'une liaison. Le chimiste et physicien américain Linus Pauling a déterminé de façon arbitraire l'échelle d'électronégativité. L'élément le plus électronégatif est le Fluor (4) et le moins électronégatif est le Césium (0,7). L'électronégativité des autres éléments varie entre ces deux mesures. L'électronégativité augmente de gauche à droite dans une période et de bas en haut dans une même famille. L'électronégativité par le symbole c. Une liaison covalente normale polarisée a lieu lorsque la différence d’électronégativité Δc est inférieure ou égale à 1,5. On obtient la différence d’électronégativité en faisant la soustraction entre la plus grande valeur et la plus base valeur. Exemple : HCl qui est H qui donne son electron à Cl tout en neutralisant la molécule avec l’énergie positive de son proton. Il est important de savoir que l'electron de H est plus souvent au cotée de Cl sans avoir été arracher. La Liaison ionique Une liaison ionique résulte d'une attraction entre ions formés par transfert d'électrons entre atomes d'électronégativités très différentes (Δc> 2) de l'atome le moins électronégatif vers l'atome le plus électronégatif. Lorsque la différence d'électronégativité est supérieure à 2, les forces en présence s'exerçant sur les électrons de l'élément le moins électronégatif sont suffisantes pour lui arracher définitivement un ou plusieurs électrons. Il ne s'agit donc plus d'une mise en commun, mais d'un don. Les charges seront donc complètes, l'élément le moins électronégatif perd un ou plusieurs électrons et devient donc un ion positif (cation) et l'élément le plus électronégatif reçoit un ou plusieurs électrons et devient donc un ion négatif (anion). Les interactions entres ces éléments sont alors des interactions d'ordre électrostatique (Force de Coulomb).
2 Commentaires
nyembo mwinyi elie
26/7/2016 06:55:06 am
je besoin d etudier la chimie,en 6e biochimie,parceque nos professeur n'arrive pas ns donner ce qu'on donne a la capitale.
Répondre
Laisser un réponse. |
Archives
Avril 2016
Catégories |


 Flux RSS
Flux RSS
