|
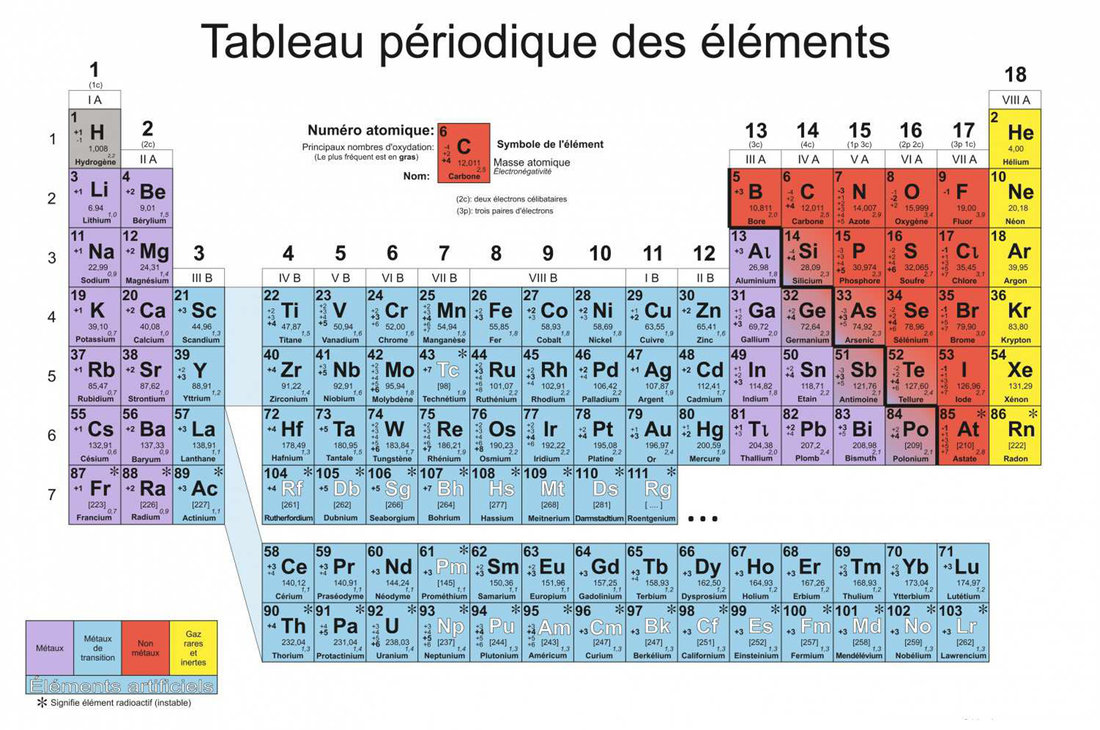
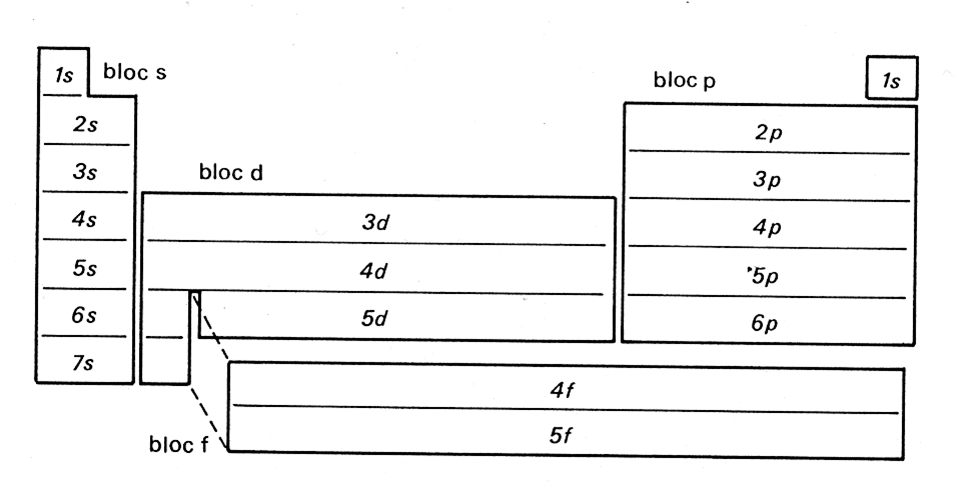
Pour comprendre le tableau périodique, il est important de comprendre la structure d’un atome. Structure électronique de l’Atome. Dans un atome, la répartition des électrons sur les orbitales atomiques d’un atome obéit à des règles. Principe de stabilité Les électrons occupent les orbitales atomiques par ordre croissant d’énergie. Le classement énergétique des orbitales atomiques se fait plus simplement selon la règle de Klechkowski. Ordre énergétique des orbitales atomiques : 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < ….. on constate que l’énergie croît avec n+l Principe de Pauli Les électrons d’un même atome ne peuvent pas avoir les mêmes quatre nombres quantiques. En conséquence, chaque orbitale atomique, caractérisée par n, l et ml contient au maximum deux électrons à spins opposés ( ½ et – ½) . Remarque : Une orbitale peut être représentée par une case ( ) dite case quantique. Chaque case quantique peut contenir au maximum, deux électrons antiparallèles (à spins opposés) Pour chaque valeur de n, il existe n2 cases quantiques ou orbitales atomiques, et par conséquent 2n2 électrons. Principe de Hund A l’état fondamental, les électrons d’une même sous couche se répartissent sur le maximum d’orbitales atomiques (orbitales atomiques dégénérées). Exception à la règle de Klechkowski L’énergie de la sous-couche (n+1)s devient supérieure à celle de nd une fois cette dernière contient un ou plusieurs électrons. Exemples: Fe, Sc, Ni… Classification des éléments chimiques Le classement des éléments se fait selon Z croissant et prend en considération la structure électronique des atomes. Les éléments dont les atomes ont la même couche externe (même n) sont rangés dans une période (ligne). Les éléments de même structure électronique externe possèdent des propriétés chimiques similaires et de ce fait, ils sont rangés dans la même colonne. Le tableau périodique comporte environ 103 éléments y compris les éléments artificiels, et se compose de 4 blocs (s, p, d et f). Bloc s (Métaux actifs) : ns1 ® alcalin et ns2 ® alcalino-terreux Bloc p (ns2npz ; 1 ≤ z ≤ 6) : Exemples: Chalcogènes (ns2np4); Halogènes (ns2np5); Gaz rares (ns2np6). Les éléments de ce bloc tels que: Si, Ge, As, Sb et Po sont des métalloïdes. Bloc d (Métaux de transition) : (n-1) dy ns2 (1 ≤ y ≤ 10) Bloc f : (n-2)fz (n-1)d ns2 ; 1 ≤ z ≤ 14. Exemples: Lanthanides (4fz 5d 6s2); Actinides (5fz 6d 7s2).
1 Commentaire
|
Archives
Avril 2016
Catégories |

 Flux RSS
Flux RSS
